Tes genomik dapat berperan dalam prediksi risiko sindrom Brugada, termasuk dalam upaya preventif mortalitas. Hal ini karena sindrom Brugada berpotensi menyebabkan aritmia yang fatal. Tes genomik menggunakan pengetahuan di bidang genetika, yang telah membuka informasi genetik manusia secara lebih luas.[1]
Sindrom Brugada adalah kelainan primer yang diturunkan secara genetik. Sindrom ini memiliki berbagai macam gejala klinik, yang meliputi sindrom primer aritmia yang fatal.[1,4]
Kelainan Genetik pada Sindrom Brugada
Sindrom Brugada (SBr) disebabkan oleh perubahan struktur dan fungsi kanal ion jantung. Perubahan ini akibat dari penurunan ekspresi gen connexin 43 (Cx43) pada ventrikel kanan, biasanya terletak di RVOT (right ventricular outflow tract), yang mengakibatkan kelainan elektromekanikal.
Kondisi ini pertama kali ditemukan pada 8 pasien pasca resusitasi kematian akibat fibrilasi ventrikel (VF) pada struktur jantung yang terlihat normal. Deskripsi SBr dikemukakan Brugada bersaudara pada tahun 1992, yang diikuti dengan penemuan panel diagnostik baru.[1,4]
Walaupun sejak awal SBr diketahui sebagai penyakit keturunan, laporan pola genetiknya baru ditemukan pada tahun 1998, yaitu gen SCN5A (sodium voltage-gated channel alpha subunit 5). Pada SBr, gen SCN5A mengalami kelainan oligogenik, yaitu mutasi dari beberapa gen mayor yang dapat mempengaruhi fungsi dasar tubuh.[1,4]
Pemeriksaan Konvensional pada Sindrom Brugada
Secara konvensional, penegakan diagnosis SBr berdasarkan EKG, sodium channel-blocking drug challenge test, serta riwayat penyakit dahulu dan riwayat keluarga.[3-5]
Gambaran EKG pasien SBr adalah tipe 1 elevasi segmen ST pada sadapan prekordial kanan (V1 dan V2), baik secara spontan maupun pasca pemberian sodium channel blocking intravena (ajmaline, flecainide, procainamide). Sementara, gejala klinik SBr biasanya terjadi saat istirahat malam, seperti sinkop, palpitasi, angina pektoris, kejang, dan sesak (nocturnal agonal respiration). Namun, >60% pasien SBr asimtomatik, di mana diagnosis ditemukan secara tidak sengaja.[1-5]
Pasien dengan gambaran EKG dugaan SBr akan dilakukan tes obat ajmaline, untuk menguji fungsi kanal ion natrium pada jantung. Akurasi tes ini cukup rendah, karena dipengaruhi oleh masa pubertas anak. Selain itu, tes ini berisiko menyebabkan komplikasi yang mengancam jiwa. Namun, tes ini masih digunakan dalam metode Shanghai score system.[5]
Peran Tes Genomik pada Sindrom Brugada
Deteksi genomik pada SBr menggunakan 16 gen yang berbeda, di antaranya SCN5A, SCN10A (sodium voltage-gated channel alpha subunit 10), HAND1 (heart and neural crest derivatives-expressed protein 1), PLN (phospholamban), CASQ2 (calsequestrin 2), CACNA1C (calcium voltage-gated channel subunit alpha 1 C), TBX3 (T-box transcription factor 3), HEY2 (hairy/enhancer-of-split related with YRPW motif protein 2) atau CHF1 (cardiovascular helix-loop-helix factor 1), dan GPD1L (glycerol-3-phosphate dehydrogenase 1 like protein).[1-6]
Gen yang paling sering ditemukan pada SBr adalah variasi gen SCN5A, yang menyumbang 15‒20% pada pasien terdiagnosis SBr dan 40% pada kasus dengan riwayat keluarga SBr. Hingga saat ini, perkembangan tes genomik SBr sudah mencapai >500 variasi/mutasi langka, dari 40 gen selain SCN5A.[1-6]
SBr-1 Gen, BRGDA1
Mutasi terjadi di lokus: 3p21-23; dengan nomor OMIM (online Mendelian inheritance in man) 601144; gen: SCN5A.
Hanya gen SCN5A yang mempunyai bukti definitif sebagai penyebab SBr. Gen ini bertugas untuk menerjemahkan kanal alpha subunit of the voltage-gated NaV1.5 cardiac sodium. Bagian voltage-gated NaV1.5 ini bertugas untuk pengaturan arus natrium pada miosit sel jantung.
Mutasi pada gen SCN5A berperan pada kelainan konduksi jantung dan fenotipe dari EKG. Pasien dengan mutasi SCN5A memiliki pemanjangan derajat gelombang P dan peningkatan voltase pada sandapan RV1 (R-wave amplitude in lead V1) dan SV5 (S-wave amplitude in lead V5). Pada anak, gen ini sangat efektif digunakan untuk deteksi dini SBr sehingga bisa melakukan terapi sedini mungkin.[1-5]
SBr-2 Gen, BRGDA2
Mutasi terjadi di lokus: 12p13.3; dengan nomor OMIM 611777; gen: GPD1L.
Gen GPD1L mempunyai efek pada kanal ion, dan mengakibatkan penurunan kadar natrium pada kanal jantung. Varian ini sangat langka, yaitu ditemukan hanya <1% dari pasien SBr, yang dapat mengakibatkan kematian mendadak akibat jantung yang tidak diketahui pada bayi usia <1 tahun.[4]
SBr-3 Gen, BRGDA3
Mutasi terjadi di lokus: 12p13.33; dengan nomor OMIM 114205; gen: CACNA1L.
Gen CACNA1L mempunyai efek pada kanal ion, dan mengakibatkan penurunan kadar kalsium pada kanal jantung. Varian ini menyumbangkan 6,6% dari kondisi SBr. Kondisi ini dapat menyebabkan kematian mendadak akibat jantung, yang biasanya ditandai oleh anomali jantung kongenital, kardiomiopati, dan ensefalopati epileptik.[4]
SBr Gen Lainnya
Mutasi gen SBr lain, sampai penelitian terakhir, adalah SBr-17 gen dan BRGDA17. Gen SCN10A dan DSP (desmoplakin) dilaporkan terdeteksi pada 8‒20% pasien SBr. Pada penelitian, mutasi gen ini dilaporkan terdapat di populasi Jepang sebanyak 2,5% dan populasi Amerika sebanyak 16,7%.[4,6]
Tes Genomik dalam Shanghai Score System
Awalnya gen SCN5A digunakan untuk penanda kelainan long QT syndrome type 3 (LQTS3), dan mulai ditetapkan sebagai penanda SBr di tahun 1998. Sejak itu, terbentuk diagnosis menggunakan Shanghai Score System. Sistem skoring ini dapat meningkatkan akurasi skrining SBr.[3-5]
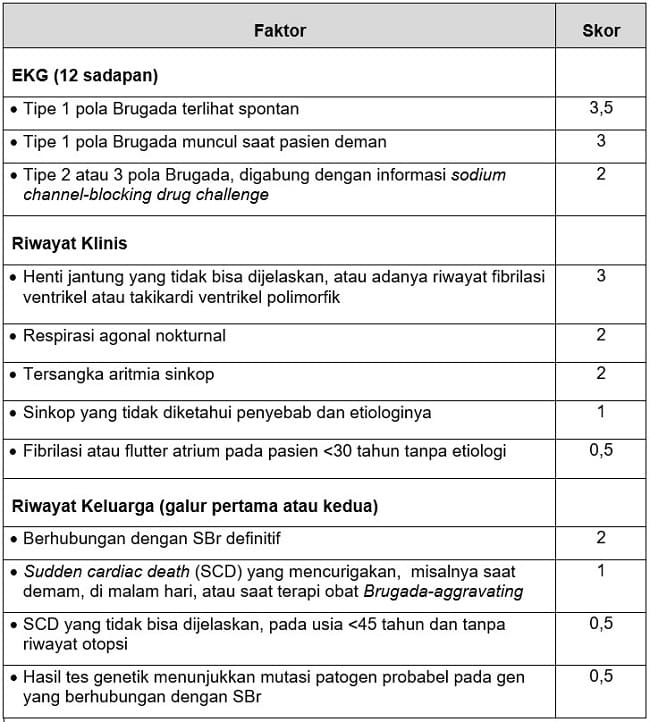
Tabel 1. Metode Shanghai Score System untuk Diagnosis Sindrom Brugada
Sumber: Ardi, 2023.[5]
Untuk menentukan SBr, dibutuhkan >1 gambaran tipe Brugada pada EKG. Sementara, penggunaan skoring di atas adalah:
Probable atau definite SBr: skor >3,5
Possible SBr: skor 2‒3
Non-diagnostic: skor 2[5]
Pencegahan dan Terapi Sindrom Brugada Berbasis Genetika
Penelitian genetik untuk keperluan diagnostik SBr banyak dikembangkan di beberapa negara, termasuk di China dan Jepang untuk wilayah Asia. Walaupun masih terbatas untuk mencegah risiko kejadian aritmia dan kematian mendadak akibat jantung.[1-4]
Pencegahan
Keunggulan dari tes genomik yaitu mendeteksi kelainan sedini mungkin, bahkan sebelum adanya gejala klinis. Pada populasi muda, hasil skrining gen SCN5A positif dapat dijadikan patokan kemungkinan mengarah penyakit SBr. Terdapat keterlibatan mitokondria sel pada skrining genetik gen SCN5A yang tidak bermutasi, biasanya disebabkan adanya modifikasi pasca translasi dari kanal sodium.[1-4]
Selain digunakan untuk diagnostik, fungsi tes genomik lainnya adalah melakukan pemetaan genetik pada keluarga yang memiliki kerentanan penyakit. Pemetaan ini termasuk stratifikasi risiko penyakit SBr, serta klasifikasi penyakit berdasarkan mutasi genetik. Dengan menggabungkan tes genomik dengan riwayat klinis dan riwayat penyakit pada keluarga, maka dapat segera dilakukan upaya pencegahan dan perubahan gaya hidup pasien yang lebih maksimal.[1-4]
Terapi
Deteksi dini dengan tes genomik bermanfaat dalam pilihan terapi yang lebih tepat sasaran. Misalnya pada anak dengan penyakit SBr dan disebabkan oleh aritmia ventrikel atau badai elektrik jantung, maka dapat diterapi menggunakan infus isoproterenol. Saat anak demam dan mengalami takikardi ventrikel monomorfik, maka dapat diterapi menggunakan beta-blocker.[1,5,6]
Selain itu, pasien yang telah terdeteksi SBr secara dini dapat disarankan melakukan Holter monitoring, tes stres EKG, dan implantable loop recorder (alat untuk merekam irama jantung secara terus menerus sampai 3 tahun), untuk evaluasi gejala sinkop dan palpitasi. Rekomendasi evaluasi penyakit SBr anak adalah kontrol spesialis kardiologis anak setiap 1‒3 tahun dengan EKG standar, serta setiap 6 tahun dengan ekokardiogram. [1,5,6]
Kesimpulan
Tes genomik efektif digunakan sebagai pemeriksaan skrining untuk sindrom Brugada (SBr). Saat ini, tes genomik untuk SBr menggunakan deteksi gen SCN5A, karena kelainan gen ini secara dominan autosom diwariskan pada pasien SBr. Penelitian lanjutan seputar gen SCN5A dilakukan untuk melihat peran gen tersebut pada fungsi mitokondria dalam sel jantung.
Pada pemeriksaan konvensional, diagnosis pasien SBr berdasarkan abnormalitas depolarisasi dan repolarisasi irama jantung yang muncul sebagai kelainan gambaran EKG. Umumnya penderita SBr asimtomatik, di mana kelainan EKG dapat ditemukan secara tidak sengaja saat pemeriksaan kesehatan rutin. Bahkan, penderita SBr baru diketahui setelah mengalami aritmia, sehingga risiko kematian mendadak akibat jantung meningkat.
Dengan tes genomik, diagnosis SBr dapat diketahui lebih dini, agar dapat dilakukan pencegahan aritmia dan perubahan gaya hidup pasien lebih maksimal. Selain itu, tes genomik SBr dapat meningkatkan efektifitas terapi, serta dapat digunakan untuk membuat pemetaan kerentanan penyakit genetik pada keluarga.
Kombinasi antara pemeriksaan genetik dengan faktor lingkungan dapat menambah informasi dan mempertajam diagnosa serta terapi di masa depan, yang mungkin dilakukan untuk penyembuhan penyakit SBr.