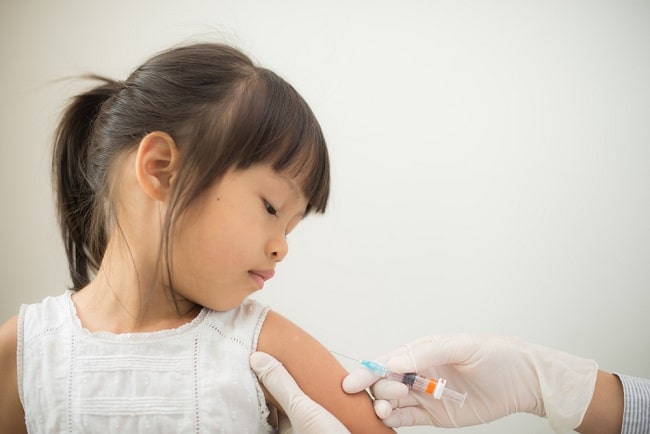
Manfaat dan keamanan vaksin dengue masih menjadi topik yang sering didebatkan. Menurut WHO, vaksin dengue idealnya harus memberikan proteksi terhadap keempat serotipe virus dengue, dapat diberikan dalam dosis tunggal, bisa memberikan imunitas jangka panjang, dan tidak memiliki efek samping serius. Namun, vaksin dengue yang ada saat ini umumnya belum memenuhi seluruh kriteria tersebut.
Demam dengue adalah penyakit infeksi yang disebabkan virus dengue. Virus dengue memiliki 4 serotipe, yaitu DENV-1, DENV-2, DENV-3, dan DENV-4. Virus ini ditransmisikan melalui gigitan nyamuk Aedes. Setiap tahunnya, diperkirakan terjadi 390 juta infeksi dengue dengan 96 juta kasus bergejala. Strategi pencegahan dengue saat ini lebih berfokus pada pengendalian vektor daripada vaksinasi.[1-3]
Sediaan Vaksin Dengue di Indonesia
Saat ini terdapat dua vaksin dengue yang telah disetujui oleh Badan Pengawas Obat dan Makanan (BPOM), yaitu vaksin CYD-TDV (Dengvaxia®) dan vaksin TAK-003 (Qdenga®). Keduanya merupakan vaksin tetravalen virus dengue hidup yang dilemahkan, dirancang untuk memberikan kekebalan terhadap keempat serotipe virus dengue (DEN-1 hingga DEN-4).
Vaksin CYD-TDV direkomendasikan untuk individu usia 9–16 tahun yang tinggal di wilayah endemik dan telah terinfeksi dengue sebelumnya (seropositif), sedangkan vaksin TAK-003 dapat diberikan pada individu usia 6–45 tahun dengan seropositif maupun seronegatif.
Di Indonesia, Ikatan Dokter Anak Indonesia (IDAI) menganjurkan vaksinasi dengue pada anak usia 9–16 tahun, tanpa perlu pemeriksaan serologi prevaksinasi. Di sisi lain, Perhimpunan Dokter Spesialis Penyakit Dalam Indonesia (PAPDI) merekomendasikan vaksin dengue pada individu usia 19-60 tahun. Pada anak dan dewasa, vaksin dengue diberikan 2 dosis dengan interval 3 bulan.[4-10]
Studi terkait Manfaat dan Efikasi Vaksin Dengue CYD-TDV
Studi di Kolombia meneliti 9.740 partisipan berusia 9–16 tahun yang menerima vaksin CYD-TDV atau plasebo dengan perbandingan 2:1. Studi tersebut menunjukkan CYD-TDV memiliki efikasi 67,5% untuk mencegah virologically confirmed dengue (VCD) simtomatik yang disebabkan serotipe apa pun mulai dari injeksi pertama hingga 25 bulan setelahnya.
Follow-up yang dilakukan selama 6 tahun juga menunjukkan berkurangnya tingkat rawat inap pada pasien dengue. Studi ini menyimpulkan bahwa CYD-TDV bermanfaat dan perlu dipertimbangkan sebagai strategi pengendalian dengue di Kolombia yang memiliki banyak area endemis.[11]
Studi lain melakukan analisis post hoc dari dua uji klinis fase 3, yaitu CYD14 (di Asia Pasifik, usia 2–14 tahun) dan CYD15 (di Amerika Latin, usia 9–16 tahun). Sebanyak 2624 peserta menerima vaksin dan 1303 menerima plasebo, dengan subgrup imunogenisitas dievaluasi berdasarkan profil antibodi terhadap empat serotipe dengue menggunakan plaque reduction neutralization test (PRNT90) untuk menentukan status monotipik atau multitipik sebelum vaksinasi.
Hasil menunjukkan bahwa efikasi vaksin CYD-TDV terhadap infeksi dengue VCD mencapai 77,4% pada peserta dengan imunitas monotipik dan 89,2% pada peserta multitipik, dengan penurunan risiko rawat infap akibat dengue sebesar 75–81% selama masa tindak lanjut 6 tahun. Efikasi lebih tinggi pada kelompok usia 9–16 tahun dan pada individu dengan paparan dengue sebelumnya.[12]
Studi terkait Manfaat dan Efikasi Vaksin Dengue TAK-003
Sebuah uji klinis fase 3, acak, tersamar ganda, terkontrol plasebo dilakukan di delapan negara endemik dengue (Brasil, Kolombia, Republik Dominika, Nikaragua, Panama, Filipina, Sri Lanka, dan Thailand). Sebanyak 20.099 anak dan remaja sehat berusia 4–16 tahun dirandomisasi dalam rasio 2:1 untuk menerima dua dosis vaksin TAK-003 atau plasebo dengan interval 3 bulan. Penelitian ini memiliki tindak lanjut rata-rata hingga 57 bulan.
Luaran utama penelitian ini adalah efikasi kumulatif vaksin terhadap infeksi dengue bergejala dan dengue yang memerlukan rawat inap sejak dosis pertama hingga akhir masa tindak lanjut. Hasil menunjukkan bahwa vaksin TAK-003 memiliki efikasi 61,2% terhadap semua kasus VCD dan 84,1% terhadap kasus yang dirawat inap.
Pada peserta seropositif sebelum vaksinasi, efikasi terhadap semua serotipe terjaga tinggi, berkisar antara 52,3% untuk DENV-3 hingga 80,4% untuk DENV-2. Di sisi lain, pada peserta seronegatif, efikasi bervariasi dengan perlindungan kuat terhadap DENV-1 (45,4%) dan DENV-2 (88,1%), namun tidak signifikan terhadap DENV-3 dan DENV-4 karena jumlah kasus yang rendah.[13]
Profil Keamanan Vaksin Dengue
Vaksin dengue umumnya dinilai cukup aman. Efek samping paling sering adalah reaksi lokal di tempat suntikan seperti nyeri, bengkak, atau ruam, serta gejala sistemik ringan seperti sakit kepala, mialgia, malaise, demam, dan astenia. Efek samping yang lebih jarang meliputi pusing, infeksi saluran pernapasan atas, nyeri orofaring, batuk, rinorea, mual, urtikaria, dan nyeri leher.[4-7]
Studi oleh Villar et al pada 20.689 anak di Amerika Latin pernah mencatat efek samping yang cukup serius, seperti serangan asma dan kejang pada 28 hari setelah pemberian CYD-TDV. Namun, anak yang mengalami efek samping dilaporkan sembuh tanpa sekuele, serta tidak ada laporan kematian dan infeksi akibat vaksin.[14]
Telaah kritis oleh Satari et al juga telah menelusuri berbagai studi untuk mengetahui keamanan vaksin dengue pada individu seronegatif yang berusia >9 tahun. Hasilnya menunjukkan bahwa risiko relatif rawat inap dan risiko dengue berat karena VCD pada kelompok tersebut tidak signifikan.[15]
Kesimpulan
Di Indonesia, vaksin dengue yang telah disetujui penggunaannya adalah vaksin CYD-TDV (Dengvaxia®) dan vaksin TAK-003 (Qdenga®). Penelitian menunjukkan bahwa kedua vaksin ini memiliki efikasi yang baik untuk mencegah infeksi dengue simptomatik dan infeksi yang memerlukan rawat inap. Dari segi keamanan, kedua vaksin ini paling sering menyebabkan reaksi lokal di lokasi injeksi dan jarang menimbulkan efek samping serius.
Ikatan Dokter Anak Indonesia telah merekomendasikan penggunaan vaksin dengue pada anak usia 9–16 tahun. Perhimpunan Dokter Spesialis Penyakit Dalam Indonesia (PAPDI) juga merekomendasikan vaksin dengue pada individu usia 19-60 tahun. Pemberian vaksin dengue dilakukan dengan injeksi 2 dosis dengan interval 3 bulan.
Direvisi oleh: dr. Bedry Qintha