Next generation sequencing (NGS) adalah hasil dari transformasi diagnosis prenatal yang berevolusi. Contoh kasus pasien: Ny. D, 34 tahun, G2P1, datang pada usia kehamilan 11 minggu untuk pemeriksaan rutin. Kehamilan sebelumnya tanpa komplikasi, dan tidak ada riwayat keluarga dengan kelainan genetik. Non-invasive prenatal testing (NIPT) dilakukan karena usia ibu berusia +35 tahun, di mana hasil NIPT (cfDNA) menunjukkan high risk for 22q11.2 deletion syndrome.
Hasil tersebut menandakan risiko tinggi untuk sindrom DiGeorge, salah satu mikrodeletion paling umum yang dapat menyebabkan kelainan jantung kongenital, gangguan imun, dan keterlambatan perkembangan. Lalu, tes diagnostik mana yang cocok untuk mengonfirmasi hasil NIPT keadaan di atas, apakah tes karyotype, microarray, atau next generation sequencing (NGS)?
Mengapa Pemeriksaan Prenatal Penting?
Pasien Ny. D di atas dilakukan NIPT karena usia ibu berusia +35 tahun. Akan tetapi, apakah NIPT hanya semata-mata dilakukan karena usia pasien di atas 35 tahun? Berdasarkan panduan HKFM (Himpunan Kedokteran Fetomaternal Indonesia) dan POGI (Perkumpulan Obstetri dan Ginekologi Indonesia), NIPT telah disarankan untuk dilakukan kepada seluruh ibu hamil.[17]
Tujuan utama skrining genetik maupun diagnosis prenatal adalah deteksi dini kelainan janin. Pemeriksaan prenatal dapat mengidentifikasi kelainan genetik, cacat lahir, maupun masalah kesehatan lainnya pada janin. Oleh karenanya, intervensi medis dapat dilakukan secara dini, termasuk penanganan yang tepat selama kehamilan atau setelah kelahiran.[6]
Selain itu, pemeriksaan prenatal juga bermanfaat dalam perencanaan kehamilan dan persalinan. Dengan mengetahui kondisi janin, orang tua dapat mempersiapkan diri secara fisik, emosional, dan finansial untuk menghadapi tantangan yang mungkin timbul. Oleh karena itu, pemeriksaan prenatal perlu dianjurkan sebagai pemeriksaan rutin dalam kehamilan terutama untuk ibu hamil dengan risiko.[6]
Sekilas Perkembangan Diagnosis Genetik Prenatal
Tes diagnostik genetik prenatal digunakan untuk memastikan ada tidaknya kondisi genetik tertentu pada janin. Pemeriksaan lanjutan ini dilakukan untuk menegakkan diagnosa dari hasil NIPT yang menunjukkan risiko tinggi.[6]
Pemeriksaan prenatal saat ini tidak hanya untuk skrining, tetapi juga sebagai tes diagnostik yang digunakan untuk memastikan ada tidaknya kondisi genetik tertentu pada janin.[6]
Awalnya, pemeriksaan prenatal menggunakan hasil USG prenatal dikombinasi dengan analisis analit serum ibu, misalnya analisis serum alpha-fetoprotein (AFP), serum total beta-HCG, serum unconjugated estriol (UE3), dan inhibin A serum, untuk mendeteksi ada tidaknya aneuploid.[2]
Tes sitogenetik pertama kali dikenalkan pada awal abad ke-20, dengan ditemukannya kromosom manusia dan diketahuinya perubahan jumlah serta struktur kromosom pada kelainan genetik. Sel manusia normal memiliki 23 pasang kromosom, yang terdiri dari 22 pasang autosom dan sepasang kromosom seks (XX atau XY). Jumlah dan morfologi kromosom tidak hanya merupakan penanda penting suatu spesies, tetapi juga merupakan dasar untuk menjaga stabilitas genetik.[3,4]
Sekilas Mengenai Tes Karyotype
Proses tes karyotype dimulai dengan pengambilan sampel, baik dari chorionic villus sampling (CVS) pada minggu ke-10 kehamilan atau dari amniosentesis pada minggu ke-15 hingga ke-18 kehamilan. Kemudian, dilakukan kultur sel dari sampel agar jumlah sel cukup untuk dianalisis.[7]
Hasil kultur diproses untuk mencapai fase metafase, di mana kromosom berada pada kondisi paling padat. Kromosom selanjutnya dilakukan pewarnaan khusus dan dianalisis di bawah mikroskop, untuk menentukan ada tidaknya abnormalitas kromosom.[7,8]
Kelainan kromosom atau disebut aberasi pada janin merupakan salah satu penyebab utama lahir mati dan kelahiran bayi dengan malformasi. Aberasi kromosom secara umum dibagi menjadi dua kategori, yaitu kelainan jumlah dan kelainan struktur. Contoh kelainan jumlah kromosom atau aneuploidi adalah sindrom Down (trisomi 21), sindrom Edwards (trisomi 18), dan sindrom Pätau 9 (trisomi 13).[3,4]
Saat ini, indikasi utama pemeriksaan sitogenetik adalah temuan ultrasonografi (USG) dan/atau biokimia yang abnormal, riwayat keguguran berulang, usia ibu lanjut (terutama >35 tahun), adanya riwayat keluarga dengan penyakit genetik, hasil tes prenatal non-invasif (NIPT) abnormal, dan adanya anomali kongenital multipel.[3,4]
Sekilas Mengenai Chromosomal Microarray Analysis (CMA)
Chromosomal microarray analysis (CMA) bekerja dengan memanfaatkan teknologi hibridisasi DNA dan fluoresensi. CMA menggunakan dua pendekatan utama, yaitu single-nucleotide polymorphism (SNP) arrays dan comparative genomic hybridization (CGH) arrays.[5]
Proses CMA meliputi pengambilan sampel dari CVS, amniosentesis, atau darah ibu, yang dilanjutkan dengan isolasi DNA, pelabelan fluoresen, hibridisasi dengan probe spesifik, dan pembacaan sinyal menggunakan scanner laser. Hasil CMA berupa profil ekspresi gen atau variasi jumlah salinan DNA, yang lebih detail dibandingkan dengan gambar kromosom dari karyotype.[5]
Menurut The American College of Obstetricians and Gynecologists (ACOG) dan Society for Maternal‐Fetal Medicine (SMFM), CMA direkomendasikan untuk diagnosis prenatal pada janin dengan satu atau lebih abnormalitas struktural. Pedoman ini didasarkan pada bukti bahwa CMA memiliki tingkat deteksi lebih tinggi daripada karyotype. Penelitian menunjukkan bahwa setidaknya 4,7% kasus janin dengan kelainan struktural memiliki kelainan microarray yang signifikan secara klinis, yang berpotensi terlewat jika hanya dilakukan karyotype.[9]
Karyotype hanya mampu mendeteksi kelainan kromosom besar yang tampak di bawah mikroskop, sedangkan CMA dapat mendeteksi copy number variants (CNVs) berukuran 10–100 kb, termasuk mikrodelesi, mikroduplikasi, dan mosaicism tingkat rendah. CMA juga lebih sensitif dalam mengidentifikasi abnormalitas kromosom klinis yang relevan, meskipun tidak dapat mendeteksi varian yang lebih kecil seperti single nucleotide variants (SNV).[5]
Next-Generation Sequencing (NGS)
NGS merupakan penemuan terbaru yang digunakan dalam penelitian genomik, yang dapat melakukan sequencing jutaan fragmen DNA sekaligus, memberikan informasi detail tentang struktur genom, variasi genetik, aktivitas gen, dan perubahan perilaku gen. NGS adalah teknologi mutakhir yang memungkinkan analisis jutaan fragmen DNA secara bersamaan, sehingga memberikan informasi detail mengenai variasi genetik dan kelainan gen.[1]
Prosesnya dimulai dari persiapan sampel, fragmentasi DNA, ligasi adaptor, amplifikasi klonal (misalnya dengan emulsion PCR atau bridge PCR), dilanjutkan dengan tahap sequencing untuk menentukan urutan basa nukleotida. Hasil sequencing kemudian dianalisis secara bioinformatik untuk mengidentifikasi mutasi atau variasi genetik yang relevan dengan penyakit.[10]
Teknologi ini hanya memerlukan sedikit DNA berkualitas tinggi (<100 ng), sehingga dapat langsung menggunakan sampel hasil CVS, amniosentesis, atau kordosentesis tanpa kultur sel.[10]
Keunggulan utama NGS adalah kemampuannya untuk melakukan berbagai tingkat analisis, mulai dari panel gen terbatas (sekitar 100–1000 gen), exome sequencing (ES), hingga whole-genome sequencing (WGS). Dibandingkan metode karyotype atau CMA, NGS mampu meningkatkan deteksi kelainan monogenik yang tidak teridentifikasi dengan teknik sebelumnya. Secara klinis, tingkat deteksi NGS berkisar 10–40% tergantung jenis malformasi yang diteliti, dengan rata-rata yield diagnostik sekitar 12,5%.[11]
Terlepas dari keunggulan NGS, hingga saat ini ACOG tidak merekomendasikan NGS secara rutin, di luar penelitian klinis hingga tersedia cukup data peer-review dan validasi. Pernyataan ini dikeluarkan pada tahun 2016, dan telah di review ulang dengan rekomendasi yang sama pada tahun 2025.[12]
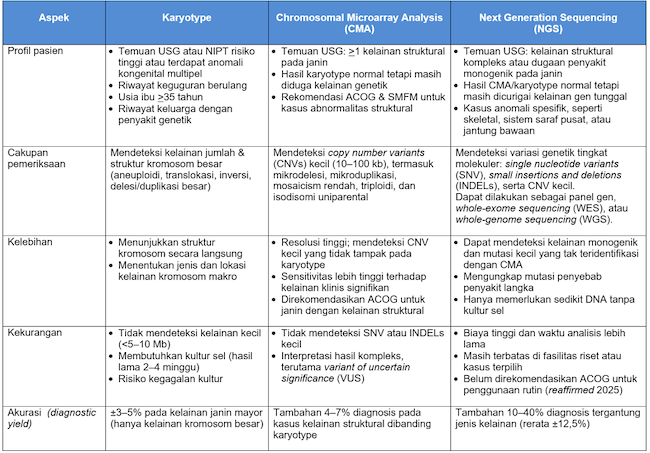
Tabel 1. Perbandingan Karyotype, CMA, dan NGS dalam Diagnosis Prenatal
Sumber: Alomedika. 2025.[3-12]
Tantangan Diagnosis Prenatal: Mengapa Sequential Testing Tidak Optimal?
Secara umum sequential testing adalah langkah pemeriksaan yang berurutan, misalnya NGS panel atau WGS, dilakukan jika karyotype maupun microarray tidak mendeteksi adanya kelainan, sementara ditemukan adanya kelainan struktural lewat USG.
Sequential testing seperti ini akan menghabiskan waktu kritis atau turn-around time, sehingga akan mempersempit pilihan klinis. Setiap “langkah” tambahan sama dengan penambahan waktu tunggu. Padahal, keputusan obstetri sering bergantung pada usia gestasi, jadi waktu sangatlah penting. Kerugian lain dari sequential testing adalah penambahan biaya, termasuk biaya pemeriksaan, serta biaya kunjungan yang berulang.[13]
Pada tahun 2024, dipublikasikan hasil studi di Inggris yang mengevaluasi efektivitas biaya dari penerapan prenatal exome sequencing (pES), dibandingkan dengan metode diagnostik standar. Studi ini merujuk 413 kasus, di mana peneliti menghitung biaya sumber daya tambahan yang dibutuhkan untuk menyediakan jalur klinis pES.[13]
Peneliti juga menghitung efektivitas biaya dengan cara membagi total biaya tambahan dengan jumlah kasus terdiagnosis. Hasil studi mendapatkan pES membebani sistem pelayanan kesehatan Inggris sebesar lebih dari 11.000 poundsterling atau sekitar 250 juta rupiah untuk setiap diagnosis tambahan.[13]
Kapan Menggunakan Next-Generation Sequencing (NGS)?
Sebuah Meta analisis oleh Mellis et al pada tahun 2022 meninjau efektivitas exome sequencing (ES) dalam mendiagnosis kelainan struktural janin, saat hasil karyotype atau CMA menunjukkan hasil normal. Analisis dilakukan terhadap 66 studi, yang melibatkan total 4.350 janin.[14]
Hasil analisis menunjukkan ES mampu memberikan diagnosis tambahan sebesar 31% daripada karyotype atau CMA saja. Dilaporkan juga, efisiensi tes ini sangat dipengaruhi oleh apakah kasus telah diseleksi terlebih dahulu melalui penilaian ahli, di mana jika dilakukan pada kasus yang dinilai kemungkinan memiliki etiologi monogenik, maka yield mencapai 42 %. Sementara, jika tes dilakukan pada kasus yang tidak diseleksi sebelumnya, maka yield hanya 15%.[14]
Hasil analisis juga menunjukkan bahwa yield ES bervariasi secara signifikan, berdasarkan tipe kelainan struktural janin. Yield paling tinggi ditemukan pada janin dengan kelainan skeletal terisolasi, sedangkan yield terendah ditemukan pada kasus dengan nuchal translucency yang meningkat secara terisolasi (seperti yang terdeteksi selama USG antenatal).[14]
Hasil ini menekankan pentingnya pemilihan kasus secara cermat. ES dapat mendukung diagnosis prenatal, khususnya untuk kondisi yang memiliki dugaan penyebab monogenik.[14]
Di Spanyol, terdapat guideline penggunaan NGS, yaitu diterapkan pada kasus yang tidak teridentifikasi setelah tes PCR maupun CMA. Selain itu, dapat dipertimbangkan pada kondisi anomali dengan hasil diagnostik >10%, misalnya anomali susunan saraf pusat tunggal, early onset fetal growth restriction berat, serta isolated heart defect.[15]
Skenario Pasca NIPT dengan Hasil Risiko Tinggi
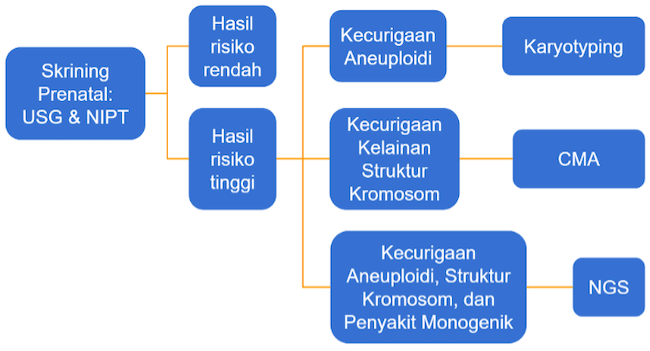
Pada praktik klinis, pemeriksaan prenatal dapat dimulai dengan NIPT. Namun, perlu diingat bahwa NIPT bukan pemeriksaan diagnostik, melainkan skrining. Pada hasil NIPT risiko tinggi dan USG menunjukkan tidak normal, pemeriksaan prenatal dilanjutkan dengan karyotype atau microarray.[16]
Namun, jika ketidaknormalan menunjukkan kondisi monogenik, dapat dipertimbangkan untuk lanjut NGS.[14,15]
Skenario Temuan Abnormalitas pada USG
NGS dapat direkomendasikan tanpa harus melalui karyotype atau microarray terlebih dahulu, jika hasil USG mendeteksi kelainan struktural tunggal atau multipel. Beberapa indikasi spesifik untuk NGA adalah kelainan pada ginjal (hiperekogenik bilateral, displastik atau polikistik), displasia skeletal, anomali berulang pada kehamilan, deformasi akinesia fetal, kraniosinostosis, anomali multipel yang melibatkan berbagai sistem, anomali sistem saraf pusat, non-isolated nuchal translucency, dan non-immune hydrops fetalis.[1]
Gambar 1. Alur Pemeriksaan Diagnostik Genetik Prenatal
Teknologi Next-Generation Sequencing (NGS) di Indonesia
Di Indonesia, teknologi NGS sudah tersedia melalui dua layanan utama, yaitu CNVSure dan Whole Exome Sequencing (WES). CNVSure mampu mendeteksi aneuploidi pada 23 pasang kromosom serta mikrodelesi/mikroduplikasi >400 kb, dengan waktu tunggu hasil 14 hari kerja.
Sementara, WES mampu menganalisis SNV di coding regions dengan dengan batas exon-intron +10‒20 base pairs, dan juga mendeteksi hingga mikrodelesi/mikroduplikasi sekecil 1 ekson. Pemeriksaan ini membutuhkan waktu tunggu hasil 30 hari kerja.
Kedua layanan ini telah didukung oleh triSure NIPT insurance support, di mana biaya bantuan akan diberikan bila hasil NIPT menunjukkan risiko tinggi dan pasien memerlukan pemeriksaan diagnostik lanjutan.
Kesimpulan
Tujuan utama diagnosis prenatal adalah deteksi dini kelainan janin, mulai dari kelainan kromosom hingga penyakit genetik monogenik. Setiap metode diagnosis memiliki kelebihan dan keterbatasan. NGS menjadi tonggak baru, karena mampu mengurutkan jutaan fragmen DNA sekaligus, menganalisis panel gen, exome, hingga seluruh genom. Namun, NGS belum direkomendasikan untuk penggunaan rutin secara global, dan hasilnya masih perlu diintegrasikan hati-hati dalam praktik klinis.
Sequential testing dapat memakan waktu kritis dan meningkatkan biaya. Padahal, keputusan obstetri sering bergantung pada usia gestasi yang sempit. Hal ini menegaskan pentingnya integrasi NGS secara tepat waktu, bukan sekadar sebagai “langkah terakhir” setelah metode lain gagal. NGS dapat mendukung diagnosis prenatal, khususnya untuk kondisi yang memiliki dugaan penyebab monogenik.
Untuk informasi produk lebih lanjut, dapat menghubungi +62-811-311-933.